Proteïne

Een proteïne of eiwit es een biologisch polymeer da in elke celle vôorkomt. Proteïnes zyn ounountbeirlik voo't vôortbestoan van ieder leevnd organisme. Der bestoan verschillige sôortn proteïnn: structurele proteïnn zittn byvôorbeeld in uw oar, moar êen van de belangrykste klasse van proteïnn zyn de enzymn. Da zyn echte fabriekskes, want ze versneln de omzettieng van substroatn in productn.
Structure
[bewerkn | brontekst bewerken]
De structure van proteïnes kan bepoald weirdn deur X-stroalnkristallografie of NMR spectroscopie. Der zyn verschillige niveaus van omschryvienge van de structure van proteïnn:
Primaire structure
[bewerkn | brontekst bewerken]Doamee bedoeln ze de ipêenvolgienge van aminozuurn in de polymeerkeetn. Een aminozuur bestoat uut een ôofdkeetn en een zykeetn. De ôofdkeetn es oltyd etzelfde (an de êne kant NH3+ en an de andere kant COO-) en reageert in nen dehydratatiereactie mé de ôofdkeetn van een ander aminozuur om het polymeer te moakn. Der zyn 20 verschillige natuurlikke sôortn aminozuurn, en et verschil zit em oltyd in de zykeetn. Ze weirdn gelyk nen collier an elkoar gehangn in verschillige combinoaties. Et aantal aminozuurn in een proteinn verschilt vrêe vele. G'eit klêene proteines, van nie mêer dan 20 aminozuurn, moar g'eit ôok vrêe grôte, van vele duusndn aminozuurn. O me nu uutgoan van een gemiddelde lengte van 200 aminozuurn, en oj e ip elke plekke keunt kiezn uut 20 meugelikeedn, ton zie je da ter praktisch ouneindig vee meugelikeedn zyn om een proteine ip te bouwn, in dit geval .
Secundaire structure
[bewerkn | brontekst bewerken]Ip da niveau beschryvn ze de ounderlienge interactie tussn de aminozuurn in de keetn. Een proteïne bestoat niet als nen lange keetn, moar vouwt em ip in verschillige substructuurn. Der zyn een aantal vormn, moar de 2 belangrykste zyn de α-helix en het ß-vlak. Die twêe vormn zyn et stabielst voo de grôte dryvnde kracht voo da proces: de woaterstofbrugvormienge tussn de atoomn van de peptide-bindienge in de ôofdkeetn. Specifieker ist e woaterstofatoom van et stikstof die interageert met et carbonylzuurstof. O een stik van de polymeerkeetn ginnen uutgesprookn vorm eit, to sprikt men van een lus of nen loop.
Tertiaire structure
[bewerkn | brontekst bewerken]Iermee weirdt de globoale structuur van nen proteïne beschreevn. De α-helices en de ß-vlakkn van een polymeerkeetn vouwn udder ip under beurt nog ne kêe tôpe om ne gecombineerde structuur te vormn. De grôte dryvnde kracht iere es veelal et hydrofoob effect: sommige zogenoamde hydrofobe chemische groepn van de zykeetns zyn nie geirn omringd deur woater en zittn liever tôpe. Ze keun da best doen deur in't middn van nen bolvormige structuur te goan zittn. De zogenoamde hydrofiele groepn zittn geirn in woater, en bluuvn ton ôok an de buutnkant van de bolvorm zittn. Een andre stabiliseernde factor zyn ipnieuw de woaterstofbruggn (moar nu ôok me de zykeetns van de aminozuurn) en de Van Der Waals interacties. Porines, of gelyk wukn tonvormig proteïne bestoan uut verschillige noast mekoar gerangschikte β-sheets. De transmembranaire porines ein hydrofobe aminozuurn an de kant van de membroan zitn en hydrofiele an de binnkant van de porie, compleet in overêenstemmieng met under functie.
Belangryk zyn ôok zwavelbrugn: dee ountstoan deur oxidatie van twee -SH groepn vo azo een -S-S- bindieng te vorm. Azo kunn twêe stikn van een eiwit a mekoar gekoppeld wordn. Ounder andere in keratine, woa da uus oar van gemakt is komt da vele voren, en tis verantwoordelik vo kruln etc.
Mêestol, moar nie olsan, es de tertiare structure verantwoordelik voo de functie van een proteïne.
Quaternaire structure
[bewerkn | brontekst bewerken]Nie olle proteines bestoan moar uut êne keetn, moar sommige tertiaire structuurn koomn tôpe om nen nog grôtere structure te vormn. Et bekenste vôorbeeld es haemoglobine die in't bloed zit en verantwoordelik es voor et transport van zuurstof en CO2. Haemoglobine bestoat uut twee keers twee verschillige keetns die een kwartetje vormn, en et wordt genoteerd of α2β. In dit geval weird er gesprookn van een heterologe combinoatie, moar g'eit ôok homologe combinoaties, dus combinoaties van dezelfde sôortn keetns. Het aantal keetns da tôpe komt es quasi ounbeperkt, en zo keun d'je der hêle fabriekscomplexn van moakn. Een ander vôorbeeld van een grôot complex es de schille van een virus, die bestoat uut ounderdn proteines. Het zyn dezelfde fysische krachtn gelik dedie die by de tertiaire structure gebruukt weirdn die zorgn voo stabilisoatie van de quartenaire structure, met uutzounderieng van zwoavelbrugn.
Post-translationele modificoaties
[bewerkn | brontekst bewerken]Eiwitn bestoan mêestol ni allene uut die 20 klassieke aminozuurn. Afwykiengn kunn voorkomn ounder de vorm van gemodificeerde aminozuurn of van niet-aminozuurgroepn die ant eiwit angn.
- In collageen komt byvoorbeeld vele hydroxyproline voren, e proline die op ze 4de koolstofatoom e hydroxylgroep bevat. 't Elpt vo de triple helix structuur van collageen stabiel te oudn deur woaterstofbrugn te maakn an de binnkant van de helices.
- Membraaneiwitn en vaak lipidegroepn of glycosidegroepn an under ippervlak. De glycosidegroepn of suukergroepn elpen vo erkennieng deur andere eiwitn, de lipidegroepn fungeren meestol als verankerieng in de membroan by oppervlakte-eiwitn.
- Een belangryke modificoatie es fosforyloatie. Aminozuurn mè ne hydroxylgroep, gelyk serine, threonine en tyrosine, keun ne fosfoatgroep krygn. Da proces weirdt gebruukt om de oeveeleid proteïne in een celle te reguleern. 't Es een rappe maniere om de concentroatie van een actief proteïne te vermindern of te vermêerdern. Fosforyloatie speelt ôok een rolle bie signoaltransductie, omda et dikwyls de trigger es om de volgende stap in et pad te activeern. Tenslotte zyn sommige fosforyloaties het begunsignoal voo de biologische degradoatie van eiwittn deur et process dat ubiquitinoatie genoemd weirdt.
Synthese
[bewerkn | brontekst bewerken]
De polymerisatiereactie woadeure da der an de ounvolledige polypeptideketen (e peptide is e korte aminozuurkeetn) een extra aminozuur gehecht wordt goat deur in et ribosoom en makt dêel ut van de zgn. translatie. De eigenlikke koppelieng noemn ze de transpeptidatie.
In de celle wordt der eerst an e molecule tRNA een aminozuur gehangn. Et tRNA is complementair an et mRNA, en functioneert als de molecule die de DNA-sequentie (d.m.v. een RNA intermediair) ommezet in eiwit. Achter anhechting kryg je een geaminoacyleerd tRNA, da ku gebruukt wordn in et ribosoom.
Deur structurele veranderiengn in et ribosoom wordt een aminozuur overgedraagn no de reeds bestoande peptideketen (die ip analoge manier al gemakt is). Da proces got azo deure toe at der in et mRNA e signaal komt die zegt da alles moe stopn: e stopcodon.
De secundaire en tertiaire structuurn kunn soms vantzelfst tot stand komn, andere kis zyn der doavoren speciale eiwitn nodig die maakn da alles ni verkeerd opplooit, de chaperone-eiwitn. Quaternaire structuurn komn mêestol spountoan tot stand deurda de ounderdeeln gemakt zyn vo i mekoar te pasn.
Functie
[bewerkn | brontekst bewerken]Proteïnn zyn de werkpeirdn van olle biologische systeimn, en z'ein vee functies. Een klêne selectie van een poar van de belangrykste zyn:
Katalysatoorn
[bewerkn | brontekst bewerken]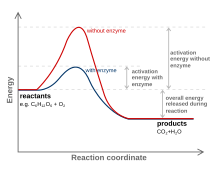
Een specioale klasse va proteïnn zyn de enzymn, die chemische reacties katalyseern. Da wil zeggn da ze bepoalde reacties gemakkelikker moakn. Oe gebeurt da? Een chemische reactie streeft er oltyd noar om noar een toestand va loagere energie te goan o je gin energie toevoegt. Moar om da te keun, moe ze êest over een energiebarriëre. Gelukkig moar, anders zoun olle chemische reacties spountoan en ouncontroleerboar gebeurn. Een enzyme zorgt ervôor da die energiebarriëre vree loage ligt, zodoanig da de reactie gemakkelikker goa startn. De mêeste enzymes keun da deurda ze een sôorte gleuve ein woarin da een bepoalde chemische verbindienge, een substroat, geirn zit. Et proteïne es deur de evolutie zodoanig veranderd da't et lik een spiegelbeeld es van et organisch molecuul. De chemische productn bindn, koomn dichter bie elkoar en goan gemakkelikker een reactie an. Der es een verschil tussn de glueve vôorn en achter de bindienge van een molecuul, moar et proteïne plôoit em als et woare noor zyn substroatn. De effect noemn ze induced fit. Deurda iedere enzyme zyn eign structuur eit, es de bindienge van chemische stoffn vrêe specifiek.
Reguloatie van gen-expressie
[bewerkn | brontekst bewerken]Een belangryke klasse van proteïnn zyn de transcriptiefactoorn. Die transcriptiefactoorn elpn de celle om de transcriptie van et DNA te vergemakkelikkn. G'eit de basale transcriptiefactoorn, die dervôor zorgn da et proces zôwiezô deuregoat. En g'eit de distale transcriptiefactoorn die vanip afstand der vôor zorgen dat de transcriptie rapper (ipreguloatie) of troager (neerreguloatie) goat, of de transcriptie van e bepaalde set genen activeert, lik et LacI genproduct (= eiwit) in E. coli da by anwezigheid van lactose en ofwezigheid van glucose makt da die bacterie ip lactose ku leevn.
Transport
[bewerkn | brontekst bewerken]Een celle weirdt ofgeschermd van de omgevienge deur de cemembroan, die een echte barriëre vormt om vrimde stoffn teegn t'oudn. Toch moetn bepoalde stoffn deuregeloatn weirdn, en da gebeurt deur zogenoamde transmembranaire proteines, die weirkn als pompn of kanoaln. In de proteïneweireld zyn der specioale α-helices ountstoan die juuste gepast zyn om de hydrofobe binnenkant van de celmembroan an te keun (in sommige gevoln worden ze ôok in combinoatie met β-sheets gebruukt). Een aantal, mêestol zeevne, van die α-helices moakn een sôort kanoal om dingn deure te loatn. De pompn zyn vrêe specifiek, zô keun de Natrium-pompn gin Kalium deureloatn en omgekêerd.
Een ander vôorbeeld van transport es et transport van zuurstof en CO2 deur heamoglobine in de bloedboane.
Signoal transductie
[bewerkn | brontekst bewerken]Soms bindt een molecuul an de buutnkant van een transmembranair proteïne zounder da er iet deuregegeevn weird an de binnenkant van een celle, et cytoplasma. Toch goat die bindienge der vôorn zorgn da de kant van et transmembranair proteïne dat an de binnenkant zit vervormd of gemodificeerd (ounder de vorm van fosforyloatie bvb.), woardeure da't er een signoal deuregegeevn weirdt an andre proteïnn om een bepoald proces in gang te zettn.
In andere gevoln zyn 't proteïnn zelve die de signaalmolecule zyn: insuline is e geknipt proteïne die de glucosebalans in et bloed regelt.
Immuniteit
[bewerkn | brontekst bewerken]
Een belangryke subklasse van proteïnn zyn de zogenoamde antilichaamn. Da zyn proteïnes die vrimde stoffn erkennn en een signoal geevn an et lichaam om doarip te reageern. De antilichoamn zyn slim gemakt: et grôotste dêel van de antilichaamn es oltyd etzelfde (constante regio), moar bepoalde lussn ip et ippervlak zyn anders (variabele regio) en erkennn verschillige sôortn vrimde stoffn. Ip die maniere zyn der wel 1012 verschillige stoffn die erkent keun weirdn.
Classificoatie
[bewerkn | brontekst bewerken]Eiwitn kunn structureel of functioneel geclassificeerd wordn. By deze latstn wordn vooral de enzymn gedocumenteerd, omda proteïnn die gin enzymn zyn praktisch allêne mo e structurele functie en (uutzounderiengn omvatn o.a. prions, et soorte eiwit da ook BSE en Creutzfeldt-Jakob verôorzakt).
Qua structurele indelieng bestoan der vele databankn, die al dan nie manueel of automatisch up-to-date gehoudn wordn. De 3 grotste zyn SCOP (Structural Classification Of Proteins), CATH (Class, Architecture, Topology en Homologous superfamily) en FSSP (Families of Structurally Similar Proteins).
SCOP
[bewerkn | brontekst bewerken]SCOP gebruukt 4 niveaus van hiërarchische classificoatie: klasse, vouw, superfamilie en familie. De klasse sloat ip de algemêne structuur van et eiwit, de vouw sloat ip gelykoardige platsieng van secundaire structuurn (dus gelykoardige tertiare structuurn), superfamilie eit betrekkieng ip functionele en structurele homologie zounder uutgesprookn sequentie-overêenkomst en familie sloat ip et niveau van sequentiehomologie.
De klassn ounderscheidn deur SCOP zyn:
- Compleet α-helicale eiwitn
- Compleet β-sheet eiwitn
- α/β domeinn die bestoan uut "beta-alpha-beta" dêeln or structurele motievn die mêestol parallelle β-sheets vormn
- α+β domeinn bestoande uut ounafankelikke α-helices en veelol antiparallelle β-sheets
- Multi-domein eiwitn
- Membraan- en celippervlakte eiwitn en peptiden (die ni meedoen int immuunsysteim)
- "Klêene" eiwitn
- Coiled-coil eiwitn
- Lage-resolutie eiwitstructuurn
- Peptiden en fragmentn
- Artificiële eiwitn mei een onnatuurlikke sequentie
CATH
[bewerkn | brontekst bewerken]CATH definieert vier klassn:
- Grotendêels α-helices
- Grotendêels β-sheets
- α-helices en β-sheets
- Winnig secundaire structuurn
FSSP
[bewerkn | brontekst bewerken]FSSP goat uut van 330 verschillige doch representatieve eiwitkeetns[1]. Al de significant gelykige eiwitn (t.e.m. 70% sequentiehomologie) wordn opgenomn per eiwitkeetn. Eiwitn me mêer of 70% homologie en mêestol gin grote structurele verschiln en zyn dus gin klasse apart.[1]
Functionele indelieng van enzymn[2]
[bewerkn | brontekst bewerken]- Oxidoreductasen - Katalyseren redoxreacties
- Transferasen - Verplatsn e functionele groep van een eiwit no 't ander (bvb. fosforylaties)
- Hydrolasen - Breekn polymeern (of geweune molecuuln) of nor under bouwstêenn me verbruuk va woater
- Lyasen - Breekn molecuuln of zounder oxidatie of hydrolyse: bvb. ATP -> cAMP + PPi
- Isomerasen - Zettn e molecule om in een isomeer va z'n eigen
- Ligasen - Angn twêe molecuuln covalent a mekoar
Biotechnologische manipuloatie van eiwittn
[bewerkn | brontekst bewerken]Eiwitmanipulatie is e groeiende branche binn de biotechnologie. De mêest voorkomende modificaties zyn veranderiengn in aminozuurn, die volgn uut de sequentie van et DNA: de eiwitmanipulatie berust dus in feite op de genetische manipulatie, tgeen die ook logisch is gezien DNA de basismachinerie van alles binn de cel codeert.
Posttranslationele modificaties komn ôok voor: et betreft ton et extra ofsplitsn van e dêel van et eiwit, ni noodzakelik aminozuurn zelve: suukergroepn of lipidegroepn anwezig ip et eiwit kunn ook geknipt wordn. 't Is meestol ambetant vo da in vivo te doen omda de celle die eiwitn als defect erkent en ze ofbrêekt. Dorom wordn die eiwitn êest geïsoleerd en ton bewerkt, doarachter kuje ze eventueel toevoegn an e digest (e mengsel van enzymn en substroat en eventueel buffer).
Referenties
[bewerkn | brontekst bewerken]- ↑ 1,0 1,1 http://srs.ebi.ac.uk/srsbin/cgi-bin/wgetz?-page+LibInfo+-lib+FSSP
- ↑ http://www.expasy.ch/enzyme/enzyme-byclass.html
| Ofbeeldiengn die ier by passn ku je vien in de categorie Proteins van Wikimedia Commons. |

