Carbong
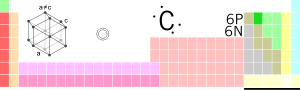
| |
| Algemêen | |
|---|---|
| Noame | Carbong |
| Symbool | C |
| Atoomnummer | 6 |
| Groep | Koolstofgroep |
| Periode | Periode 2 |
| Blok | p-blok |
| Reekse | Niet-metoal |
| Kleur | Kleurloos |
| Chemische eignschapn | |
| Atoommassa (u) | 12,011 g.mol-1 |
| Elektronconfiguroatie | [He]2s22p2 |
| Oxidoatietoestandn | [-4, +2, +4] |
| Elektronegativiteit (Pauling) | 2,55 |
| Atoomstroale (pm) | 77 |
| 1e ionisoatiepotentioal (kJ×mol-1) | 1086,46 |
| 2e ionisoatiepotentioal (kJ×mol-1) | 2352,65 |
| 3e ionisoatiepotentioal (kJ×mol-1) | 4620,50 |
| Fysische eigenschapn | |
| Dichtheid (kg·m-3) | 2620 |
| Hardheid (Mohs) | 0,5/10,0 |
| Smeltpunt (K) | 3725 |
| Kookpunt (K) | 4827 |
| Aggregoatietoestand | Vaste |
| Smeltwarmte (kJ·mol-1) | 105 |
| Vanderwaalsstroale (pm) | 170 |
| Kristalstructuur | Hex |
| Molair volume (m3·mol-1) | 3,42/5,31 |
| Geluudssnelheid (m·s-1) | 18350 |
| Specifieke warmte (J·kg-1·K-1) | 710 |
| Elektrische weerstand (μΩcm) | 1375 |
| Warmtegeleidboarheid (W·m-1·K-1) | 140 |
| SI-êenheedn en standoardtemperateure en -druk wordn gebruukt, of 't zou moetn zyn dat et er anders stoat. | |
Carbong of koolstoffe es een element van de tabelle van Mendeljev. 't Stoat in de 14ste groep en in de twidde periode, en 't ed atoomnummer 6. In chemische formules wordt et weregegeven deur C. Et woord carbong wor ôok gebruukt vo de stoffe die e miengelieng is tusschen carbongvezels en kunsthars.
Ipbouw
[bewerkn | brontekst bewerken]Et carbongatoom bestoat in de regel uut 6 protoonn, 6 elektroonn, en 6 neutroonn. 98,9% van alle koolstof ip eirde bestoat uut et zogenoamde 12C-isotoop. 1,1% bestoat uut 13C, en sporenelementen van 14C (zie ôok massagetal). Neutroal carbong ed 1s22s22p2 als elektronenconfiguroatie.

Belang
[bewerkn | brontekst bewerken]Carbong is vooral belangeryk als de basis van al 't leven da wieder kenn. Een organische molecule is per definitie intje die round e koolstofatoom opgebouwd is, en de reden da carbong ier ideaal voen is, is da 't alle oxidoatietoestandn tusschen -4 en 4 kat anneemn, en me zen eigen ku bienden. 't Ed ook de meugelikeid voen energetisch hêel stabiele molecuuln te maken, lik de aromaatn die vele voornkomn in uus lichaam. 't Komt praktisch assan voorn in covalente biendiengn, en in de praktyk gebeurt da met ounder andere O, H, N, en S; vaneigens komn der ook andere biendiengn voorn, moa in levende organismen zyn dedee de belangrykste.

Carbong komt ook voorn in andere toepassiengn, lik crayongs en ook geweune potloodn. Et grafiet in e potlood bestoat uut zuver carbong. Zuver carbong komt wel ni allene voren in potloodn, we vienden da ôok in diamant, fullereenn, en 't belooft ook schone toepassiengn te kunn ein in de nanotechnologie.
Polymeern zyn stofn die bestoan uut een eralienge van gèèsan etzelfste basisbouwbloksje of e klèène variatie dervan. In uus lichaam zyn de belangrykste dergelikke polymeern DNA, eiwitn, sukers, en vetn of lipiden. In de anorganische chemie bestoan der ôok maniern vo polymeern te gebruukn: azo en we diengn lik plastiek, vinyl, caoutchou, en nog vele mêer.
Nog e stief belangryke toepassieng viendn we in de archeologie, mo ton wel ni direct op vlak van molecuuln en biendiengn. Koolstof-14 daterienge gebruukt de halfwoardetyd van radioactief 14C voen te bepaaln oe oud da een organisch twa is. Der wordt noamelik veroundersteld da der e constante verouding is van radioactief carbong en ni-radioactief carbong in heel de weireld. Uutgoande doavan kunn ze, deur et gehalte 14C in je stale, werereeknen noa wanneer da je plante, mens, bacterie,... gestorven is (en zodoende gestopt is met koolstof op te neemn).
Voorts komt der vele van uze energie uut koolstofbiendiengn. Petrol, glucose ('tgèèn die in vele organismen de boasisbron is van energie), en methoan (of butoan of propoan) zyn allemalle gebaseerd ip carbong.
Ten latste is 't ook nog weird voen te vermeldn da sommige carbongoxiden e speciale rolle en: CO2 wordt gezien als de voornoamste oorzake van global warming, carbongzeur (H2CO3-) is e belangryke buffer in uus bloed, en CO kenn we allemalle van et gevoar vo vergiftigieng dat da creëert.
Geschiedenisse
[bewerkn | brontekst bewerken]Carbong is al siends de prehistorie bekend, wannêer da ze 't miekn deur organisch materioal te verbrandn by ounvoldoende zuurstof. 't Komt ôok voren in hemellichoamn lik de zunne (als dêel van de carbong-stikstofcyclus), sterrn, komeetn en de atmosfeern van vele planeetn. In sommige meteorietn kom et ôok voorn als microscopisch diamant.
De noame van carbong komt van et Latynsche carbo die 'kool' wil zegn.
| Ofbeeldiengn die ier by passn ku je vien in de categorie Carbon van Wikimedia Commons. |
